Ung thư dạ dày
1. Đại cương ung thư dạ dày
1.1. Ung thư dạ dày là gì?
Ung thư dạ dày là các tế bào trong dạ dày bắt đầu phát triển ngoài tầm kiểm soát, khối tế bào đó tạo thành các khối u, có thể lan sang các khu vực khác trong cơ thể ( di căn)
Ung thư dạ dày cho đến nay vẫn là một UT phổ biến trên thế giới. Mỗi năm theo công bố của tổ chức ghi nhận UT toàn cầu (IARC) có khoảng 870.000 người mới mắc, 650.000 người chết do căn bệnh này. Ung thư dạ dày có tỷ lệ mắc đứng thứ 3 ở nam, thứ 4 ở nữ. Tuy nhiên tỷ lệ này có xu hướng giảm xuống nhanh trong một vài thập kỷ vừa qua do những hiểu biết về cơ chế sinh bệnh có liên quan đến H. pylori, chế độ ăn và một số yếu tố môi trường, tỷ lệ mắc UT dạ dày cũng khác nhau theo khu vực địa lý, mắc cao ở Đông á, Nam Mỹ và Đông Âu, tỷ lệ mắc thấp ở Bắc Mỹ, Bắc âu và phần lớn các nước ở châu Phi và Đông nam á. ởViệt nam UT dạ dày đứng vị trí thứ 3 ở cả 2 giới, tỷ lệ mắc chuẩn theo tuổi 21,8 ở nam, 10,0 ở nữ. Tỷ lệ mắc UT dạ dày thay đổi theo địa lý. Theo ghi nhận UT của Bệnh viện K từ năm 1997 đến nay, UT dạ dày ở Hà Nội luôn đứng hàng thứ 2 sau UT phổi, còn ở Hải Phòng, Huế, Cần Thơ đứng hàng thứ 3 sau UT phổi, gan.
Xem thêm nguồn nước ngoài từ Hiệp hội ung thư Hoa Kỳ: https://www.cancer.org/cancer/stomach-cancer/about.html
1.2. Nguyên nhân ung thư dạ dày
1.2.1. Tổn thương tiền ung thư
Viêm dạ dày mạn tính kéo dài sẽ dẫn đến viêm teo mạn tính niêm mạc dạ dày, tiếp theo là các biến đổi dị sản của tế bào, tiếp đến là các biến đổi loạn sản tế bào qua từng mức nhẹ, vừa đến nặng và biến đổi cuối cùng dẫn đến là Ung thư.
1.2.2. Yếu tố môi trường
Quan sát cho thấy những người di cư từ các vùng, nước có tỷ lệ mắc UT dạ dày cao đến vùng, nước có tỷ lệ mắc UT dạ dày thấp, thì nguy cơ mắc UT dạ dày của nhóm dân cư này cũng giảm xuống. Kết quả này cho thấy vai trò rõ ràng của yếu tố môi trường liên quan đến nguyên nhân gây UT dạ dày.
Tập quán sống
Các vùng địa lý khác nhau có tỷ lệ ung thư dạ dày khác nhau và các dân tộc khác nhau ở cùng một vùng địa lý cũng có tỷ lệ khác nhau cho nên tập quán sống có lẽ đóng vai trò quan trọng như chế độ ăn uống. Yếu tố nguy cơ tăng lên được nhiều nghiên cứu chỉ ra khi ăn các loại thức ăn có chứa Nitrates và Nitrites như thịt hun khói, thịt cá ướp muối, cũng như rau, dưa muối… Trái lại khi ăn nhiều rau hoa quả tươi giàu vitamin A, C hình như tỷ lệ UT dạ dày thấp hơn. Cứ nghĩ uống rượu làm tăng nguy cơ ung thư dạ dày nhưng một số nghiên cứu lại thấy không rõ ràng. Trong khi thuốc lá làm tăng đáng kể tỷ lệ này, đặc biệt UT dạ dày phần tâm – phình – vị.
Nhiễm vi khuẩn
Vi rút Epstein-Barrcó vai trò đặc biệt trong ung thư vòm, tuy nhiên một nghiên cứu tại Hàn Quốc cho thấy vi rút Epstein-Barrcó trong tế bào của 13% các bệnh nhân ung thư dạ dày và một số hình thái tế bào ở dạ dày giống với các tế bào UT vòm, trái lại không tìm thấy vi rút Epstein-Barrtrong các tế bào của các tổn thương loét lành tính, hoặc các tổ chức bình thường. Người ta ước tính có khoảng 5-10% UT dạ dày có liên quan đến vi rút Epstein-Barrtrên toàn thế giới. Đây có thể là nguyên nhân gây ung thư dạ dày
Helicobacter pylori, nhiều giả thuyết cho rằng Helicobacter pylori là nguyên nhân UT dạ dày đặc biệt là UT 1/3 dưới. Helicobacter pylori gây nên viêm niêm mạc dạ dày mạn tính nhất là viêm mạn teo đét (Chronic Atrophic gastritis) được coi là thay đổi tiền UT (Procursor lesions for cancers). Gần đây nguời ta còn cho rằng Helicobacter pylori có một týp nào đó có thể gây những biến đổi hóa học của một số loại thức ăn có nguy cơ UT cao thành các chất hóa học làm tổn thương DNA của tế bào niêm mạc dạ dày.
Tình trạng kinh tế xã hội
Những người ở mức kinh tế xã hội thấp có tỷ lệ mắc UT dạ dày vùng thân vị cao gấp 2 lần trong cộng đồng dân cư. Ngược lại những cư dân có mức kinh tế xã hội cao lại có tỷ lệ mắc cao hơn UT dạ dày vùng tâm vị.
Chỉ số BMI (Body Mass Index)
Những người béo phì dễ bị UT hơn người bình thường nhất là UT phần tâm vị. Gần một nửa số bệnh nhân UT tâm vị liên quan đến thuốc lá và béo phì.
Phẫu thuật dạ dày
Tiền sử phẫu thuật cũng là yếu tố nguyên nhân tăng mắc ung thư dạ dày, thời điểm phát triển UT cao nhất khoảng 15-20 năm sau phẫu thuật, loại phẫu thuật liên quan đến nguy cơ mắc ung thư dạ dày cao hơn như phẫu thuật Billroth II cao hơn Billroth I.
Tuổi và giới
Tuổi và giới được ghi nhận là những yếu tố nguy cơ quan trọng. Nam giới có tỷ lệ gấp đôi nữ giới ở mọi thống kê của Việt Nam (Bệnh viện K) cũng như của Nhật Bản và Mỹ. Tuổi từ 50 trở lên càng nhiều tuổi, khả năng UT dạ dày càng cao. Ở Mỹ phần lớn ung thư dạ dày phát hiện ở tuổi 60, 70 và 80.
1.2.3. Yếu tố nội sinh
Nhóm máu
Một số báo cáo cho thấy người có nhóm máu A hay bị ung thư dạ dày hơn các nhóm máu O, B, AB, trong các bệnh nhân UT dạ dày có khoảng 20% bệnh nhân có nhóm máu A.
1.2.4. Yếu tố di truyến
Gen di truyền viêm teo dạ dày mạn tính có thể truyền từ mẹ sang con chiếm 48%, ngoài ra ung thư dạ dày còn liên quan đến một số hội chứng di truyền như bệnh ung thư đại trực tràng di truyền không đa polyp, bệnh đa polyp tuyến, hội chứng Peutz Jeghers.
Gần đây người ta phát hiện sự đột biến di truyền của E-cadherin gene (CDH1), xảy ra trong tế bào sinh dục có liên quan đến ung thư dạ dày di truyền, sự thay đổi gen CDH1 được tìm thấy 50% ở các bệnh nhân ung thư dạ dày, khi gen này bị đột biến nó mất khả năng kiểm soát tế bào, điều này cho thấy E-cadherin gene (CDH1) là một gen ức chế sự phát sinh và phát triển của tế bào ung thư dạ dày.
1.3. Sinh bệnh học và mô bệnh học
Sinh bệnh học
Sinh bệnh học của ung thư biểu mô tuyến dạ dày, chia 2 loại týp ruột và týp lan tỏa. Mỗi loại khác nhau về mặt hình thái, cơ chế sinh bệnh và sự biến đổi về gen. Trong khối u týp ruột, các tế bào gắn kết nhau, có xu hướng sắp xếp thành ống tuyến giống như các ung thư biểu mô tuyến đường tiêu hoá khác (biệt hoá cao), ngược lại đối với týp lan tỏa các tế bào u thiếu sự gắn kết, không tạo ống tuyến, xâm lấn mạnh vào tổ chức xung quanh (không biệt hoá).
Ung thư biểu mô tuyến týp ruột có liên quan đến các yếu tố môi trường như thói quen, tập quán sống… khối u týp ruột có liên quan đến H. pylori, sự nhiễm khuẩn này có thể xảy ra từ lúc mới sinh, lúc trẻ, trải qua thời gian dài 3-4 thập kỷ các tế bào biến đổi qua nhiều giai đoạn viêm dạ dày mạn tính, viêm teo dạ dày mạn tính, dị sản ruột, loạn sản ruột và ung thư biểu mô tuyến dạ dày.
Ung thư biểu mô tuyến týp lan tỏa liên quan chủ yếu đến sự biến đổi di truyền, nhiều nghiên cứu đã nhắc đến vai trò của gen E-cadherin gene (CDH1), đây là một gen ức chế sự phát triển của khối u, khác với týp ruột, ung thư biểu mô tuyến týp lan tỏa, không rõ giai đoạn phát triển tiền ung thư.
Mô bệnh học
1.4. Khối u loại biểu mô
Khối u nội biểu mô – u tuyến
Ung thư biểu mô
Ung thư biểu mô tuyến
Týp ruột
Týp lan tỏa
Ung thư biểu mô tuyến nhú
Ung thư biểu mô ống tuyến
Ung thư biểu mô tuyến nhày
Ung thư biểu mô tế bào nhẫn
Ung thư biểu mô tuyến vảy
Ung thư biểu mô vảy
Ung thư biểu mô tế bào nhỏ
Ung thư biểu mô không biệt hoá
Carcinoid – Khối u nội tiết biệt hoá cao
1.5. Khối u không biểu mô
U cơ trơn
U bao sợi thần kinh (Schwannoma)
U tế bào hạt
Sarcom cơ trơn
U mô đệm đường tiêu hoá
Sarcom Kaposi
1.6. Lymphô ác tính
U lymphô tế bào B vùng rìa (MALT)
U lymphô tế bào Mantle
U lymphô lan tỏa tế bào B lớn
2. Triệu chứng – Chẩn đoán ung thư dạ dày
Phần lớn ung thư dạ dày khi được chẩn đoán đã là giai đoạn muộn lan tràn, không còn khả năng điều trị triệt căn. Ở Mỹ khoảng 50% số người ung thư dạ dày khi được chẩn đoán đã ở giai đoạn muộn hoặc xâm lấn rộng hoặc có di căn xa, chỉ 50% bệnh nhân bệnh còn ở giai đoạn tại chỗ và có khả năng điều trị phẫu thuật triệt căn. Do vậy chẩn đoán sớm ung thư dạ dày ở các quốc gia có tỷ lệ ung thư dạ dày cao như Nhật Bản (cao gấp 5 lần Mỹ) Hàn Quốc, các nước vùng Đông á, vùng Andean ở nam Mỹ… và nhất là ở Việt Nam là vấn đề rất lớn. Ở Việt Nam theo số liệu ghi nhận UT của đề tài KC 10.06 ước tính trong 4 năm 2001 – 2004 có khoảng 19.100 người được chẩn đoán là UT dạ dày (số liệu này còn rất xa với thực tế) và 2/3 số này được chẩn đoán ở giai đoạn muộn.
Xem thêm chi tiết: Triệu chứng ung thư dạ dày
2.1. Chẩn đoán sớm ung thư dạ dày
Ung thư dạ dày sớm (Early gastric cancer) là UT biểu mô tuyến chỉ giới hạn ở lớp niêm mạc, dưới niêm mạc của dạ dày và có thể đã có di căn hạch hoặc chưa có di căn hạch vùng (T1Nx), có tiên lượng tốt hơn so với ung thư dạ dày xâm nhập (T2Nx), do vậy việc sàng lọc, phát hiện sớm ung thư dạ dày quyết định hiệu quả điều trị, thời gian sống. Các triệu chứng lâm sàng của UT dạ dày sớm thường ít như đau thượng vị, khó tiêu (65-90%), buồn nôn, nôn (6-40%), chán ăn (12-40%), các dấu hiệu muộn hơn như sút cân, thiếu máu. Tuy nhiên để chẩn đoán UT dạ dày sớm vẫn chủ yếu dựa vào nội soi, bấm sinh thiết nhiều vị trí nghi ngờ. Ở Nhật Bản vào khoảng trên 60% bệnh nhân được chẩn đoán ung thư dạ dày sớm. Tại Mỹ ước chừng được 10-20% và ở Việt Nam theo một số báo cáo tại viện Việt – Đức, Bệnh viện 108 và Bệnh viện K con số này cũng chỉ dao động ở khoảng trên dưới 10%. Có sự khác nhau đó là tại Nhật bản người ta tiến hành sàng lọc hàng loạt bằng biện pháp nội soi dạ dày, tá tràng có và không có nhuộm màu. Tổn thương được nhuộm hoặc bằng Indago carmin hoặc Indianinks có phân tử nhỏ hoặc đơn giản bằng xanh methylen. Như vậy tất cả những người từ 45 tuổi trở lên định kỳ 6 tháng/1 lần được nội soi dạ dày hàng loạt. Nhờ vậy tỷ lệ ung thư dạ dày sớm được phát hiện ngày càng cao. Ở Việt Nam, theo nghiên cứu của Bệnh viện K, tất cả những người từ 45 tuổi trở lên, nếu có các triệu chứng lâm sàng nghi ngờ nên đi khám và soi dạ dày. Chỉ có nội soi, sinh thiết từ 3 mảnh trở lên mới có hy vọng chẩn đoán sớm, chẩn đoán chính xác UT dạ dày .
2.2. Chẩn đoán ung thư dạ dày
2.2.1. Đặc điểm triệu chứng ung thư dạ dày lâm sàng
Cũng như phần chẩn đoán ung thư dạ dày sớm, chẩn đoán ung thư dạ dày ngày nay không còn là vấn đề lớn, chỉ có điều bệnh nhân có đến với thầy thuốc hay không? Và đến ở giai đoạn nào? Tuy nhiên các triệu chứng lâm sàng thường mờ nhạt ở giai đoạn sớm, khi đã rõ ràng thì đã ở giai đoạn tiến triển.
Sút cân và đau bụng dai dẳng là những triệu chứng phổ biến thường gặp khi bệnh nhân đến khám và được chẩn đoán, sút cân có thể do ăn uống kém, tăng dị hoá, do đau, buồn nôn, nuốt nghẹn…
Đau bụng vùng thượng vị có thể do đau thần kinh phế vị, đau nhẹ nếu bệnh ở giai đoạn sớm, đau nhiều khi ở giai đoạn muộn hơn.
Nuốt nghẹn thường xuất hiện khi khối u phát triển gần tâm vị, hoặc đoạn nối với thực quản.
Buồn nôn, đầy hơi gặp ở một số bệnh nhân u lan rộng, hoặc khối u ở vùng môn vị gây cản trở lưu thông thức ăn.
Chảy máu dạ dày – ruột kín đáo có thể dẫn đến tình trạng thiếu máu thiếu sắt, hiếm khi chảy máu nặng.
Khối u thành bụng khi thăm khám xảy ra khi khối u ở thân vị, thường là giai đoạn muộn.
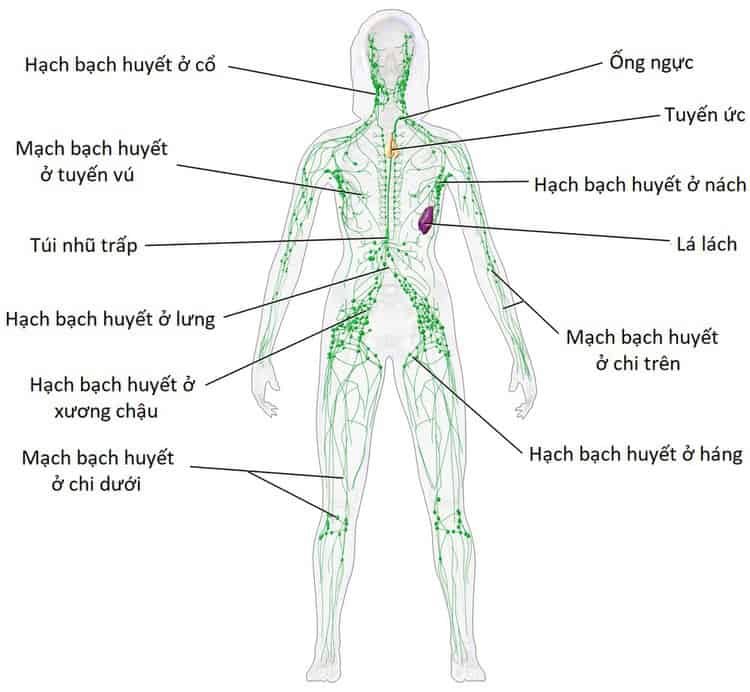
Những dấu hiệu khối u lan rộng: khi khối u thâm nhiễm qua thành dạ dày gây dò dạ dày-đại tràng, gây tắc ruột do thâm nhiễm vào đại tràng đây là những trường hợp hiếm. Khi tế bào UT lan rộng qua hệ thống hạch lymphô, chúng ta có thể khám thấy hạch thượng đòn trái, hạch nách trái, hạch quanh rốn. Có khi tế bào ung thư lan tràn qua đường ổ phúc mạc, di căn buồng trứng (Krukenberg), di căn gan đa ổ, có thể gây vàng da, gây tràn dịch ổ bụng…
2.2.2. Triệu chứng cận lâm sàng
Nội soi dạ dày tá tràng ống mềm
Đây là một biện pháp hữu hiệu nhất để chẩn đoán ung thư dạ dày. Với các cải tiến mới từ fiberscop đến vidioscop tổn thương có thể được phóng đại lên nhiều lần và được hội chẩn ngay trên màn hình thậm chí nhờ nối mạng có thể được hội chẩn từ xa (tele medical consultant) và nếu nghi ngờ tiến hành nhuộm màu và thực hiện kỹ thuật sinh thiết 7 mảnh đạt độ chính xác cao 95-99%, trong quá trình soi bên cạnh bấm sinh thiết, ta có thể thực hiện chải tế bào bổ sung thêm cho phương pháp sinh thiết.
Ở Việt Nam phần lớn các bệnh viện tuyến tỉnh đã có được trang bị kỹ thuật này, thậm chí ở cả một số trung tâm y tế huyện.
Chẩn đoán hình ảnh khác
$1- Chụp dạ dày-tá tràng có Baryt hàng loạt: đây là một kỹ thuật kinh điển, nó giúp cho việc chẩn đoán các bệnh lý dạ dày tá tràng rất tốt trước khi nội soi ống mềm được phổ cập. Ngày nay nó vẫn còn được sử dụng không phải với mục đích chẩn đoán là chính mà chủ yếu để đánh giá mức độ lan rộng giúp cho đặt chẩn đoán giai đoạn.
$1- Computed Tomograply (CT-Scan) ổ bụng: đây là một phương pháp chẩn đoán không can thiệp, nhưng chủ yếu để đánh giá tình trạng xâm lấn các tổ chức xung quanh và đặc biệt để đánh giá tình hình di căn: gan, hạch, tình trạng ổ bụng, ổ phúc mạc, dịch… tuy nhiên hạn chế của CT là không thể phát hiện các tổ thương nhỏ hơn 5 mm, hay đánh giá sự xâm lấn của u theo chiều sâu, hoặc tình trạng hạch di căn.
$1- Siêu âm nội soi (Endoscopic-Ultrasound): đầu phát sóng siêu âm, được đưa cùng với ống nội soi (như đã mô tả) vào dạ dày tá tràng; ngoài việc quan sát qua hình ảnh nội soi, nhờ có sóng siêu âm, bác sĩ khám bệnh còn đánh giá độ sâu, độ xâm lấn của khối u vào thành dạ dày ra sao, di căn hạch và các cơ quan lân cận như thế nào. Đây là một trang bị tương đối đắt tiền nhưng rất cần thiết nhất là ở các bệnh viện chuyên ngành và bệnh viện lớn. Vì nó cho phép không chỉ chẩn đoán mà còn giúp đánh giá giai đoạn bệnh khá chính xác.
$1- Positron Emisson Tomography (PET): trong xét nghiệm này người ta thường sử dụng glucose đánh dấu phóng xạ. Vì tổ chức UT tiêu thụ glucose nhanh hơn rất nhiều so với tổ chức lành, vì vậy tổ chức UT sẽ là nơi tập trung nồng độ phóng xạ cao. PET tuy vẫn còn được nghiên cứu nhưng khả năng phát hiện những ổ UT nhỏ (tiền lâm sàng) cũng như các ổ di căn nhỏ của ung thư dạ dày là đầy hứa hẹn.
$1- Laparoscopy: đây là phương pháp chẩn đoán phục vụ cho xếp giai đoạn chính xác hơn. Đầu camera được đưa vào ổ bụng qua một lỗ mở nhỏ, camera cho phép quan sát, đánh giá lần cuối cùng mức độ xâm lấn của khối u, di căn hạch và di căn các tạng khác. Đây là phương pháp chẩn đoán can thiệp, tuy nhiên nó có ưu điểm đánh giá kỹ hơn các tổn thương nhỏ trên bề mặt gan, tình trạng ổ phúc mạc, tình trạng hạch, ngay cả PET scan cũng chỉ phát hiện được các tổ thương ổ phúc mạc 50%.
$1- Các xét nghiệm khác: chụp phổi đánh giá lan tràn của bệnh, các chỉ điểm u CA125, CA19.9, CA72.4 có thể tăng trong ung thư dạ dày, một số bệnh nhân tăng CEA.
2.3. Chẩn đoán giai đoạn ung thư dạ dày
Chẩn đoán giai đoạn bệnh ung thư nói chung và ung thư dạ dày nói riêng là một công đoạn cực kỳ quan trọng. Giai đoạn bệnh có thể nói là một trong những yếu tố có tính chất quyết định đến kế hoạch điều trị, chọn lựa mô thức điều trị và có giá trị tiên lượng độc lập. Nhiều bệnh có thể xếp giai đoạn bằng các yếu tố lâm sàng, cận lâm sàng trước mổ (clinical stage) nhưng cũng có loại phải có đủ dữ liệu sau khi mổ, sau khi làm giải phẫu bệnh mới phân loại được (Pathologic stage). Đối với UT dạ dày, phân giai đoạn sau mổ có vẻ hợp lý nhất: Có nhiều hệ thống phân giai đoạn của UT dạ dày được áp dụng: Phân giai đoạn theo Dukes, theo UICC, theo WHO. Nhưng một bảng phân loại được nhiều người chấp nhận là phân giai đoạn của UICC mà Hiệp hội chống ung thư Hoa Kỳ AJCC sử dụng. Và sau đó bổ sung cách phân loại giai đoạn của NCI – Nhật Bản.
Trong đó:
– T: U nguyên phát
Tis: (carcinoma insitu) tế bào ung thư chỉ giới hạn ở lớp niêm mạc dạ dày. Mảng đáy chưa bị phá vỡ.
- T1: tế bào ung thư xâm lấn qua lớp niêm mạc tới lớp hạ niêm mạc (Lamina propria hay Submicosa).
- T2: khối u xâm lấn đến lớp cơ qua lớp niêm mạc và dưới niêm mạc (T2a) hoặc qua lớp cơ đến lớp dưới thanh mạc (Subserosa). T2b.
- T3: khối u xâm lấn đến thanh mạc nhưng chưa xâm lấn vào tổ chức hoặc cơ quan lân cận.
- T4: khối u xâm lấn qua thanh mạc vào các cơ quan hoặc tổ chức lân cận như các mạch máu lớn.
– N di căn hạch
No: không có di căn hạch vùng.
N1: di căn từ 1 – 6 hạch dạ dày.
N2: di căn từ 7 – 15 hạch cạnh dạ dày.
N3: di căn trên 15 hạch cạnh dạ dày.
– M di căn xa
Mo: không có di căn
- M1: có di căn xa.
– Xếp giai đoạn theo TNM (của AJCC)
Giai đoạn 0: Tis, No, Mo hay còn được gọi cancer insitu giai đoạn sớm nhất của ung thư – ung thư tại chỗ.
Giai đoạn IA: T1NoMo
IB: T1N1Mo hoặc T2a/b NoMo.
Giai đoạn II: T1N2Mo hoặc T2a/b N1Mo hoặc T3NoMo.
Giai đoạn IIIA: T2a/b N2Mo hoặc T3N1Mo hoặc T4NoMo.
IIIB: T4N1-3Mo hoặc T1-3N3Mo hoặc T bất kỳ M1.
Tuy nhiên cách phân loại này chỉ dựa vào số lượng hạch mà định No, N1, N2 hay N3 do vậy mắc phải một trở ngại là không đánh giá đến mức độ di căn hạch gần hay xa so với u nguyên phát. Vì thế các tác giả Nhật Bản (JRSCC) đưa sơ đồ và đánh số thứ tự với 3 vùng của ung thư dạ dày:
Bảng 1.
|
N1 |
N2 |
N3 |
N4 |
|
|
Ung thư 1/3 dưới |
3.4.5.6 |
1.7.8.9 |
11.12.13 |
15.16 |
|
Ung thư 1/3 giữa |
3.4.5.6.1. |
7.8.9.10. |
12.13.14. |
15.16 |
|
Ung thư 1/3 trên |
1.2.3. |
5.6.7.8. |
12.13.14. 9.10.11. |
15.16 |
|
Ung thư toàn bộ dạ dày |
1.2.3.4. 5.6. |
7.8.9.10. 11.12. |
13.14. |
15.16. |
Và đưa ra bảng phân loại như sau:
Bảng 2.
|
Po HoMo |
Po H1 No, N1, N2 |
IV b |
|||||
|
No |
N1 |
N2 |
N3 |
||||
|
Po Ho Mo |
T1 |
I a |
I b |
II |
III a |
IV a |
|
|
T2 |
I b |
II |
III a |
III b |
|||
|
T3 |
II |
III a |
III b |
IV a |
|||
|
T4 |
III a |
III b |
IV a |
||||
|
P1 Ho T1,2,3 |
IV a |
IV b |
|||||
|
IV b |
|||||||
Di căn đến các chặng càng xa (N càng lớn) thì tiên lượng càng nặng. Do vậy N1, N2, N3 trong hệ thống TNM của AJCC cũng như UICC khác với N1,2,3,4 của các nhà UT Nhật Bản. Tương ứng với vét N1, N2, N3, N4 của các nhóm hạch, các tác giả Nhật Bản xác định vét hạch D1, D2, D3 và D4.
Và như vậy phân giai đoạn của ung thư dạ dày cũng còn đang được bàn cãi. Khi phân giai đoạn chúng tôi lấy AJCC (2005) là chính nhưng khi phẫu thuật chúng tôi lấy việc vét hạch theo các tác giả Nhật Bản làm tiêu chuẩn. Ngoài ra bảng phân loại nữa cũng hay được dùng, đó là phân giai đoạn theo Dukes. Phân loại của Dukes (1932) được áp dụng vào ung thư dạ dày bởi Adachi (1994) như sau:
Dukes A: ung thư xâm lấn niêm mạc, dưới niêm mạc và lớp cơ dạ dày (To, T1, T2) No.
Dukes B: ung thư đã lan tới thanh mạc (T3) No.
Dukes C: – (Ca) To, T1, T2, T3, T4 với 1 – 6 hạch di căn
– (Cb) Di căn từ 7 hạch trở lên.
3. Điều trị ung thư dạ dày
Việc lựa chọn phương pháp điều trị phụ thuộc vào nhiều yếu tố: giai đoạn bệnh, sức khoẻ bệnh nhân nói chung và các bệnh kèm theo, khả năng của thầy thuốc cũng như trang thiết bị của bệnh viện. Ở đây chúng tôi trình bày biện pháp điều trị chuẩn.
Trước hết phải nói phẫu thuật là phương pháp chủ yếu và quan trọng trong điều trị ung thư dạ dày. Vài trò của hóa trị và xạ trị điều trị được cân nhắc phối hợp cho từng trường hợp cụ thể.
3.1. Điều trị phẫu thuật
3.1.1. Phẫu thuật điều trị triệt căn
Phẫu thuật cắt niêm mạc qua nội soi (Endofcopic mucosal resection)
Việc cắt bỏ tổn thương UT qua nội soi chỉ được thực hiện khi UT còn đang giới hạn ở lớp niêm mạc (Tis) và qua các phương tiện chẩn đoán khác kể cả nội soi ổ bụng (Laparoscopy) không có hạch di căn.
Cắt gần toàn bộ dạ dày (Subtotal gastrectomy)
Thường chỉ định cho ung thư dạ dày 1/3 dưới hoặc ranh giới 1/3 dưới và 1/3 giữa với giai đoạn 0, I, II, III và bao giờ cũng kèm theo vét hạch D1 hoặc D2. Ở đây có 2 khái niệm cần được làm rõ. Cắt gần toàn bộ dạ dày (Subtotal gastrectomy) được dùng để chỉ khi cắt dạ dày cách bờ trên tổn thương 5-6cm nếu u <T3 và 6-8cm nếu u T4. Vét hạch DII với UT 1/3 dưới dạ dày là vét hết hạch chặng 2. (tức là các nhóm 1, 3, 4, 5, 6, 7, 8, 9) theo sơ đồ hạch ung thư dạ dày của các tác giả Nhật Bản. Việc phục hồi lưu thông tiêu hóa thường theo Billroth II. Có thể kèm theo miệng nối Braunn để chống trào ngược.
Cắt toàn bộ dạ dày (Total gastrectomy)
Được chỉ định cho UT 1/3 giữa và 1/3 trên của dạ dày. Với UT vùng tâm vị, việc cắt thực quản bụng phải đảm bảo không còn tổ chức UT ở diện cắt (nếu có điều kiện làm chẩn đoán giải phẫu tức thì) thường phải cách cực trên tổn thương 5-7cm. Khi cắt toàn bộ dạ dày việc vét hạch các nhóm 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 rất thuận lợi nghĩa là vét D1, D2, D3 rất điển hình. Do vậy có xu hướng mở rộng chỉ định cắt toàn bộ dạ dày trong ung thư dạ dày nói chung và UT 1/3 giữa, 1/3 trên được nhiều tác giả ủng hộ. Trong khi ở Nhật Bản, Hàn Quốc, tỷ lệ cắt toàn bộ dạ dày do UT nói chung chiếm 30% khi mà tỷ lệ chẩn đoán sớm đạt được đến mức 50-60% thì ở Việt Nam tỷ lệ cắt toàn bộ dạ dày do UT chỉ đạt ở mức 10-15%. Có rất ít tài liệu báo cáo đạt 30%. Nhiều phẫu thuật viên lo ngại biến chứng nặng, tỷ lệ tử vong cao do cắt toàn bộ dạ dày gây nên, nhưng các báo cáo chính thức không chứng minh điều đó. Các tác giả Âu-Mỹ cũng lo ngại điều này, nhưng các báo cáo của tác giả Nhật Bản, Hàn Quốc và cả Việt Nam đều thấy cắt toàn bộ dạ dày vét hạch D2 không làm cho bệnh nhân nặng thêm.
Cắt gần toàn bộ và cắt toàn bộ dạ dày mở rộng
Khi tổ chức ung thư xâm lấn vào các bộ phận xung quanh như đại tràng ngang, thân đuôi tụy, lách, nhất là gan trái hạ phân thuỳ II, III việc cắt bán phần hoặc toàn bộ dạ dày mở rộng cắt kèm theo các bộ phận bị xâm lấn mang tính triệt căn vẫn có thể đặt ra. Tuy nhiên nếu xét khả năng phẫu thuật không thể lấy hết tổ chức UT thì nên đặt vấn đề phẫu thuật điều trị triệu chứng.
3.1.2. Phẫu thuật điều trị triệu chứng
Phẫu thuật điều trị triệu chứng là một biện pháp hữu hiệu để điều trị chống đau và chăm sóc triệu chứng cho bệnh nhân ung thư dạ dày. Gần đây có nhiều trung tâm còn khuyên nên cắt dạ dày (nếu toàn trạng cho phép) để điều trị ung thư dạ dày khi không còn chỉ định điều trị triệt căn thậm chí cả cắt toàn bộ dạ dày điều trị triệu chứng. Nếu đánh giá giá toàn trạng trước mổ cho phép, việc cắt bỏ được khối u cũng làm cho chất lượng sống của người bệnh được cải thiện đáng kể, đồng thời còn đề phòng được tình trạng vỡ u chảy máu, viêm phúc mạc hoặc hẹp môn vị sau này.
Ngoài ra các biện pháp nối vị tràng nếu UT ở 1/3 dưới lan rộng, di căn xa hoặc mở thông dạ dày, hỗng tràng nuôi dưỡng khi UT ở 1/3 giữa, 1/3 trên lan rộng.
Như vậy phẫu thuật là vũ khí chính trong điều trị ung thư dạ dày kể cả ở giai đoạn sớm cũng như giai đoạn muộn.
Vấn đề phẫu thuật điều trị ung thư dạ dày còn nhiều khía cạnh bàn cãi, cắt gần toàn bộ hay toàn bộ? Vét hạch D1, D2 hay D3, D4… nhưng kinh nghiệm mổ của phẫu thuật viên, kỹ thuật cũng như kỹ xảo trong mổ và nhất là vét hạch là yếu tố quyết định đến tiên lượng của người bệnh. Các tác giả Âu-Mỹ đánh giá cao các phẫu thuật viên Nhật Bản về khía cạnh này và cho rằng đó là lý do tỷ lệ sống 5 năm của bệnh nhân ung thư dạ dày ở Nhật Bản cao hơn ở Mỹ (>60% Nhật Bản và 23% ở Mỹ – 2005).
3.1.3. Phẫu thuật điều trị tái phát
Đối với các tái phát tại chỗ ở dạ dày, hoặc vị trí thực quản – dạ dày, nhiều nghiên cứu ủng hộ việc cắt khối tái phát, hoặc các cơ quan lân cận nhằm mục đích nâng cao chất lượng sống, cải thiện thời gian sống.
Trong một số trường hợp khối di căn gan đơn độc, ở vị trí có thể phẫu thuật được, nhiều người cũng ủng hộ quan điểm phẫu thuật cắt bỏ khối di căn có thể nâng cao chất lượng sống cũng như thời gian sống cho bệnh nhân.
3.2. Hóa trị điều trị ung thư dạ dày
Hóa trị điều trị ung thư dạ dày có thể được áp dụng như là biện pháp chính khi UT đã có di căn xa, hoặc cũng có thể dùng như biện pháp điều trị hỗ trợ trước phẫu thuật (Neo-adjuvant) và điều trị hỗ trợ sau phẫu thuật (adjuvant), ngoài ra hoá chất có thể phối hợp với xạ trị để nâng cao kết quả của điều trị. Tất cả các biện pháp đều nhằm nâng cao hiệu quả điều trị, nâng cao chất lượng sống cũng như tăng thời gian sống cho người bệnh.
3.2.1. Hoá xạ trị đồng thời bổ trợ
Một thử nghiệm lớn gần đây tại Mỹ do Intergroup trial 0116tiến hành trên các bệnh nhân ung thư dạ dày đã được phẫu thuật, gồm 556 bệnh nhân chia 2 nhóm, một nhóm được điều trị hoá xạ trị đồng thời, nhóm kia được quan sát theo dõi. Kết quả theo dõi 3 năm cho thấy thời gian sống không bệnh so sánh giữa 2 nhóm 48%><27 tháng. Từ kết quả nghiên cứu này đã làm thay đổi quan điểm điều trị ung thư dạ dày tại Mỹ, trước đây ung thư dạ dày sau phẫu thuật triệt căn không phải điều trị mà chỉ theo dõi, nhưng nay phác đồ chuẩn sau phẫu thuật ung thư dạ dày tại Mỹ là điều trị bổ trợ hoá xạ trị đồng thời. Tuy nhiên phần lớn những bệnh nhân trong thử nghiệm này là ở T3, T4 và 85% có di căn hạch vùng. Phương thức điều trị cụ thể như sau:
Hoá trị phác đồ FUFA x đợt 1
5FU 425mg/m2/ngày x 5 ngày truyền tĩnh mạch
Leucovorin 20mg/m2/ngày x 5 ngày truyền tĩnh mạch
Hoá trị phác đồ FUFA x đợt 2 tiến hành sau 1 tháng kết hợp xạ trị tổng liều 45Gy, 1,8Gy/ngày đồng thời với hoá chất
5FU 400mg/m2/ngày x 7 ngày truyền tĩnh mạch (4 ngày đầu tiên và 3 ngày cuối cùng của xạ trị).
Leucovorin 20mg/m2/ngày x 7 ngày truyền tĩnh mạch (4 ngày đầu tiên và 3 ngày cuối cùng của xạ trị).
Hoá trị phác đồ FUFA x đợt 3 và 4 tiến hành 1 tháng sau khi hoá-xạ trị đồng thời kết thúc.
5FU 425mg/m2/ngày x 5 ngày truyền tĩnh mạch
Leucovorin 20mg/m2/ngày x 5 ngày truyền tĩnh mạch
Một thử nghiệm khác tại Hàn Quốc cũng áp dụng phương thức điều trị giống Intergroup trial 0116, thử nghiệm này gồm 544 bệnh nhân nhóm hoá xạ đồng thời, 446 bệnh nhân nhóm theo dõi, nhưng đối tượng bệnh nhân sau khi được phẫu thuật vét hạch D2, giai đoạn II-IV (chưa có di căn xa) cũng cho kết quả tốt ở nhóm hoá xạ trị đồng thời.
Tại Bệnh viện K, chúng tôi đang tiến hành thử nghiệm hoá xạ trị đồng thời trên một số bệnh nhân ung thư dạ dày sau phẫu thuật, tuy nhiên kết quả còn đang ở giai đoạn theo dõi.
3.2.2. Hoá trị liệu bổ trợ
Cho tới nay đã có hơn 30 thử nghiệm với các thuốc khác nhau, được áp dụng cho điều trị bổ trợ sau phẫu thuật ung thư dạ dày, tuy nhiên các thử nghiệm cho kết quả khác nhau, một số thử nghiệm ủng hộ hóa trị bổ trợ, một số khác cho kết quả không mong muốn.
Một phân tích lớn gần đây, đánh giá kết quả 12 thử nghiệm lâm sàng, được tiến hành tại châu á và Tây âu (bao gồm một thử nghiệm lớn tại Nhật bản), tiêu chuẩn là bệnh nhân sau khi được phẫu thuật triệt căn vét hạch D2, giai đoạn II-III, phải đáp ứng R0 (-) tức là diện u phải không còn tế bào UT, sau đó bệnh nhân sẽ được sử dụng đơn hoá chất S1 (đây là một thuốc có sự phối hợp giữa Tegafur và gimeracil, oteracil). Kết quả phân tích cho thấy S1 có vai trò bổ trợ sau phẫu thuật, nhóm uống S1 cho kết quả cải thiện thời gian sống 3 năm 80,1%>< 70,1% (nhóm chỉ phẫu thuật). Do vậy hiện nay tại Nhật Bản và một số nước châu âu đã áp dụng S1 cho điều trị bổ trợ ung thư dạ dày sau phẫu thuật.
Phương thức điều trị cụ thể: áp dụng cho bệnh nhân ung thư dạ dày giai đoạn II-III, được phẫu thuật triệt căn vét hạch D2, diện cắt không còn tế bào UT, bắt đầu sử dụng S1 trong vòng 6 tuần sau phẫu thuật.
S1 40mg/m2x 2 lần/ngày x 28 ngày uống, 14 ngày nghỉ, chu kỳ 6 tuần, sử dụng thuốc trong 1 năm.
3.2.3. Hoá trị bổ trợ trước
Hoá trị bổ trợ trước thường được biết đến với mục đích làm giảm giai đoạn, giúp cho phẫu thuật được dễ dàng, ngoài ra nó còn giúp ngăn cản di căn xa ở những bệnh nhân có nguy cơ cao giai đoan T3-4, có dịch màng bụng dương tính, thể chai. Phương pháp này được áp dụng cho các bệnh nhân có thể phẫu thuật và bệnh nhân được cho là không thể mổ (chưa có di căn xa) tại thời điểm chẩn đoán. Đã có một số thử nghiệm tiến hành so sánh nhóm được hóa trị sau đó phẫu thuật, nhóm kia chỉ phẫu thuật. Kết quả cho thấy nhóm kết hợp tốt hơn về thời gian sống không tái phát cũng như sống toàn bộ và tỷ lệ được phẫu thuật triệt căn cao hơn ở nhóm được hoá trị.
Thử nghiệm Magic: đây là một thử nghiệm lớn được tiến hành ở Anh với 503 bệnh nhân, chủ yếu là ung thư dạ dày (74%), ung thư thực quản 1/3 dưới (11%), đoạn nối thực quản dạ dày (15%); bệnh nhân sẽ được chia làm 2 nhóm, một nhóm được phẫu thuật đơn thuần, nhóm còn lại được điều trị 3 đợt hoá chất bổ trợ trước ECF (Epirubicin, cisplatin và 5FU), sau đó sẽ được phẫu thuật và điều trị tiếp 3 đợt ECF bổ trợ. Kết quả của nghiên cứu cho thấy nhóm được hóa trị có sự cải thiện thời gian sống 5 năm từ 23% lên 36%; giảm tỷ lệ tái phát tại chỗ từ 21% xuống 14%, tỷ lệ tái phát di căn xa từ 37% xuống 24%.
Thử nghiệm French được tiến hành tại Pháp cũng cho kết quả ủng hộ hóa trị bổ trợ trước trong ung thư dạ dày. Từ kết quả của 2 thử nghiệm tại Anh và Pháp, hiện nay tại châu âu và một số nơi trên thế giới người ta áp dụng điều trị bổ trợ trước cho ung thư dạ dày như một phác đồ chuẩn.
3.2.4. Hoá xạ trị bổ trợ trước
Chủ yếu áp dụng cho điều trị ung thư dạ dày giai đoạn muộn tại chỗ, chưa có di căn xa, mục đích chủ yếu chuyển từ giai đoạn không phẫu thuật được thành giai đoạn có thể phẫu thuật. Đã có một số kết quả nghiên cứu bước đầu cho thấy hoá xạ trị bổ trợ trước có thể thay đổi 70% từ giai đoạn không phẫu thuật được, thành giai đoạn phẫu thuật được, trong đó 30% đạt tỷ lệ thoái lui hoàn toàn về giải phẫu bệnh.
3.2.5. Hoá trị liệu trong ung thư dạ dày giai đoạn muộn
Mục tiêu của hoá trị liệu là giảm nhẹ triệu chứng và cải thiện thời gian sống cho người bệnh. Đã có rất nhiều các thử nghiệm lâm sàng so sánh hoá trị liệu và chăm sóc hỗ trợ, kết quả cho thấy hoá trị liệu cải thiện thời gian sống 6 tháng so với bệnh nhân chỉ được chăm sóc hỗ trợ.
Đơn hoá trị liệu
Hoá chất kinh điển: được áp dụng từ nhưng năm 1990, thường đạt được sự thoái lui bệnh dưới 6 tháng, hiếm khi đạt được sự thoái lui hoàn toàn. Các thuốc cũ gồm bleomycin, mitomycin-C, methotrexat, 5-fluorouracil(5-FU), etoposid, cisplatin và doxorubicin.
Hoá chất mới: cho kết quả đáp ứng và thời gian sống cao hơn, tuy nhiên tỷ lệ độc tính cao hơn, thời gian sống trung bình khoảng 9 tháng. Các thuốc mới bao gồm taxanes (docetaxelvà paclitaxel), irinotecan, vinorelbin, oral fluoropyrimidines (Capecitabin và S1).
Đa hoá trị liệu
Các thử nghiệm lâm sàng đã chứng minh được, đa hoá trị liệu cho kết quả tăng cao tỷ lệ đáp ứng so đơn hoá trị liệu, tuy nhiên thời gian sống được cải thiện không đáng kể so đơn hoá trị liệu (những thử nghiệm này sử dụng các thuốc kinh điển trong phác đồ, mà chưa có các thuốc mới)
Phác đồ có cisplatin:
Cisplatin + S1: có hiệu quả cao ở nhóm bệnh nhân châu á, một thử nghiệm Spirits đã chứng minh được nhóm điều trị cisplatin + S1 cho tỷ lệ đáp ứng, thời gian sống trung bình cao hơn so với nhóm chỉ điều trị S1 đơn thuần (54%><13 tháng).
ECF (Epirubicin, cisplatin, 5FU): cho tỷ lệ đáp ứng 41%
ECX (Epirubicin, cisplatin, Xeloda): cho tỷ lệ đáp ứng 46%
EOF (Epirubicin, oxaliplatin, 5FU): cho tỷ lệ đáp ứng 42%
EOX (Epirubicin, oxaliplatin, Xeloda): cho tỷ lệ đáp ứng 48%
Thời gian sống toàn bộ có xu hướng cải thiện ở phác đồ có sử dụng xeloda, oxaliplatin, độc tính ít hơn ở phác đồ oxaliplatin.
Phác đồ có anthracyclin + 5FU:
FAM (5-FU, doxorubicin và mitomycinC)
- FAMTX(methotrexat liều cao, 5-fluorouracilvà doxorubicin).
EAP và ELF: EAP (etoposid, doxorubicin và cisplatin) so sánh với FAMTX, cho tỷ lệ đáp ứng thấp hơn và độc tính cao hơn; ELF (etoposid, 5-FU và leucovorin) phù hợp cho bệnh nhân già trên 65 tuổi và có vấn đề về tim mạch.
Phác đồ có Taxan (Paclitaxel và docetaxel)
Paclitaxel và cisplatin: cho tỷ lệ đáp ứng 43-49%, thời gian sống trung bình 9-13 tháng.
Paclitaxel và cisplatin, 5FU: cho tỷ lệ đáp ứng cao hơn, thời gian sống được cải thiện, tuy nhiên tai biến nhiều, độc tính nặng nề hơn.
Docetaxel, cisplatin, 5FU hoặc xeloda (TCF): phác đồ TCF so với CF, tỷ lệ đáp ứng, thời gian sống không bệnh tiến triển, sống 2 năm cao hơn ở phác đồ có Docetaxel (37%>< 9%). Phác đồ TCF được xác chuẩn cho điều trị ung thư dạ dày giai đoạn muộn tại Châu Âu và Mỹ.
Docetaxel và xeloda: cho tỷ lệ đáp ứng 39-46%; thời gian sống không bệnh tiến triển 4,2-6,1 tháng; thời gian sống toàn bộ trung bình 8,4-15,8 tháng.
Phác đồ có oxaliplatin: các nghiên cứu đã chứng minh phác đồ có oxaliplatin không những có hiệu quả trong ung thư đại trực tràng, mà nó còn có hiệu quả trong ung thư dạ dày, thực quản.
EOF-EOX (Epirubicin, Oxaliplatin, 5FU- Epirubicin, Oxaliplatin, Xeloda)
FOLFOX (Leucovorin, 5FU, Oxaliplatin)
XELOX (Oxaliplatin, Xeloda)
Các phác đồ có oxaliplatin cho tỷ lệ đáp ứng 40-67%, thời gian sống trung bình 8-15 tháng. Nhiều nghiên cứu đã cho thấy khi thay thế cisplatin bởi oxaliplatin, cho kết quả như nhau, tuy nhiên tác dụng phụ của oxaliplatin ít hơn.
Phác đồ có Irinotecan:
Irinotecan+cisplatin cho tỷ lệ đáp ứng 58%, thời gian sống trung bình 9 tháng.
Irinotecan+docetaxelcho tỷ lệ đáp ứng 26%, thời gian sống trung bình 7,3 tháng.
Irinotecan + docetaxel + cisplatin cho tỷ lệ đáp ứng 54%, thời gian sống không bệnh và toàn bộ là 7,1 và 11,9 tháng.
Irinotecan+fluoropyrimidines:
Phác đồ FOLFIRI > 5-FU/leucovorin tỷ lệ đáp ứng 40%><9,5 tháng.
Phác đồ Irinotecan+Xeloda cho tỷ lệ đáp ứng 44%, thời gian sống trung bình 11 tháng.
Irinotecan + oxaliplatin (FOLFOXIRI): (irinotecan, oxaliplatin,leucovorin, 5-fluorouracil đây là một phác đồ cho kết quả ấn tượng với tỷ lệ đáp ứng 67%, thời gian sống trung bình không bệnh tiến triển và chung là 9,6 tháng và 14,8 tháng.
3.3. Các yếu tố sinh học
Yếu tố có đích là EGFR: khoảng 25% ung thư dạ dày giai đoạn muộn có bộc lộ yếu tố phát triển biểu mô loại týp II EGFR (Her 2/neu), có tỷ lệ tương tự trong UT vú, hay xảy ra ở týp ruột hơn týp lan tỏa (32%><6%).
Trastuzumab: là một kháng thể đơn dòng kháng lại yếu tố phát triển biểu mô Her 2/neu, chủ yếu được áp dụng trong ung thư vú. Hiệu quả của trastuzumab trong ung thư dạ dày giai đoạn muộn có Her 2/neu (+), đã được chứng minh trong thử nghiệm pha 3 ToGA, bệnh nhân phải có Her 2/neu (+3) hoặc Fish (+), Capecitabin + cisplatin trastuzumab, kết quả cho thấy nhóm có trastuzumab có tỷ lệ đáp ứng, thời gian sống trung bình cao hơn, tỷ lệ đáp ứng 47%><11,1 tháng.
Cetuximab: là một kháng thể đơn dòng ức chế thụ thể yếu tố phát triển biểu mô (EGFR), nó được chứng minh trong một thử nghiệm pha 2 ung thư dạ dày thực quản giai đoạn muộn, khi kết hợp hoá trị liệu cho tỷ lệ đáp ứng 50%, sống trung bình 10 tháng.
Các phân tử nhỏ ức chế men tyrosine kinase:
Lapatinib: là một phân tử thuốc nhỏ có tác dụng ngăn cản yếu tố phát triển biểu mô týp I và týp II (Her 2/neu), qua ức chế men tyrosin kinase. Tuy nhiên nó đang được nghiên cứu kết hợp với paclitaxel theo tuần, bước đầu cho kết quả nhiều hứa hẹn.
Gefitinib, Erlotinib: đang được nghiên cứu trong ung thư dạ dày thực quản giai đoạn muộn.
Yếu tố có đích là VEGF: việc tăng yếu tố phát triển nội mạch máu liên quan đến tiên lượng xấu trong ung thư dạ dày giai đoạn có thể mổ được, bởi vì khi yếu tố phát triển nội mạch tăng lên, thì nhiều mạch máu tân tạo được hình thành, do vậy u sẽ phát triển nhanh hơn, mạnh hơn.
Bevacizumab: là một kháng thể đơn dòng ức chế yếu tố phát triển nội mạch máu, nó được áp dụng trong điều trị UT đại trực tràng, phổi, vú. Gần đây được ứng dụng điều trị UT dạ dày giai đoạn muộn, phác đồ phối hợp Bevacizumab + cisplatin + irinotecan cho tỷ lệ đáp ứng 65%, thời gian sống trung bình 12,3 tháng.
Sunitinib: là một phân tử nhỏ ức chế men tyrosin kinase của thụ thể phát triển nội mạch máu, đang được nghiên cứu điều trị ung thư dạ dày giai đoạn muộn.
3.4. Xạ trị trong ung thư dạ dày
Thường dùng nguồn xạ từ ngoài vào hoặc Co60 hoặc gia tốc – Xạ trị thường được chỉ định để tiêu diệt nốt số lượng nhỏ tế bào UT còn sót lại hoặc không thể lấy hết bằng phẫu thuật. Một số nghiên cứu chỉ ra rằng, phối hợp xạ trị với hoá chất 5FU/LV có thể kéo dài thời gian sống và cải thiện chất lượng sống của bệnh nhân sau mổ. Thậm chí xạ trị còn được chỉ định để điều trị một số triệu chứng của ung thư dạ dày như đau, chảy máu hoặc hẹp môn vị – Liều khuyến cáo thường từ 36-50Gy phân liền 2Gy/ngày, tuần 5 ngày.
Tác dụng phụ của xạ trị như bỏng da mức độ nhẹ, nôn, buồn nôn, ỉa chảy… thường giảm hẳn sau 2-3 tuần ngừng xạ trị.
4. Tiên lượng của ung thư dạ dày
Ung thư dạ dày đứng hàng thứ 2 về nguyên nhân gây tử vong do ung thư trên toàn thế giới. Tỷ lệ mắc ở Việt Nam cũng cao (đứng hàng thứ 2 và 3). Tuy thấp hơn ở Nhật Bản và Hàn Quốc, đông bắc Trung Quốc… nhưng tỷ lệ sống 5 năm còn rất thấp. Các nước Âu, Mỹ, Anh… tỷ lệ này chỉ vào khoảng 20-25%. Nhật Bản và Hàn Quốc có tỷ lệ khỏi bệnh cao nhất (trong khi dùng ít hóa trị) 60-65% vượt xa 20-25% cách đây 20 năm. Như vậy phát hiện sớm, kỹ thuật mổ sẻ hoàn thiện sẽ nâng cao tỷ lệ sống quá 5 năm nhanh hơn phẫu thuật phối hợp hóa trị. Do đó tiên lượng ung thư dạ dày chưa thật sáng sủa nhưng đề phòng tốt, phát hiện sớm, hoàn thiện kỹ thuật mổ sẻ và phối hợp hóa trị bổ trợ hợp lý sẽ nâng cao hơn nữa kết quả điều trị trong tương lai không xa.
4.1. Một số phác đồ trong điều trị ung thư dạ dày
4.1.1. Phác đồ hóa xạ đồng thời bổ trợ sau phẫu thuật FUFA áp dụng cho giai đoạn IB, II, III
Hoá trị phác đồ FUFA x đợt 1
5FU 425mg/m2/ngày x 5 ngày truyền tĩnh mạch
Leucovorin 20mg/m2/ngày x 5 ngày truyền tĩnh mạch
Hoá chất phác đồ FUFA x đợt 2 tiến hành sau 1 tháng kết hợp xạ trị tổng liều 45Gy, 1.8Gy/ngày đồng thời với hoá chất
5FU 400mg/m2/ngày x 7 ngày truyền tĩnh mạch (4 ngày đầu tiên và 3 ngày cuối cùng của xạ trị).
Leucovorin 20mg/m2/ngày x 7 ngày truyền tĩnh mạch (4 ngày đầu tiên và 3 ngày cuối cùng của xạ trị).
Hoá chất phác đồ FUFA x đợt 3 và 4 tiến hành 1 tháng sau khi hoá xạ trị đồng thời kết thúc.
5FU 425mg/m2/ngày x 5 ngày truyền tĩnh mạch
Leucovorin 20mg/m2/ngày x 5 ngày truyền tĩnh mạch
4.1.2. Hóa trị liệu bổ trợ:
S1 40mg/m2x 2 lần/ngày x 28 ngày uống, 14 ngày nghỉ, chu kỳ 6 tuần, sử dụng thuốc trong 1 năm.
4.1.3. Hoá trị bổ trợ trước
Sử dụng phác đồ ECF-ECX
Phác đồ điều cho ung thư giai đoạn muộn tại chỗ và di căn.
Phác đồ Cisplatin + S1:
S1 25mg/m2x 2 lần/ngày x 21 ngày uống
Cisplatin 75mg/m2 truyền tĩnh mạch ngày 1
Chu kỳ 28 ngày
Epirubicin + Cisplatin + 5-FU (ECF)
Epirubicin 50mg/m2 tiêm tĩnh mạch ngày 1
Cisplatin (CDDP) 60mg/m2 truyền tĩnh mạch ngày 1
5-FU 200mg/m2/ngày truyền tĩnh mạch liên tục 21 ngày
Chu kỳ 21 ngày, trong 8 chu kỳ
Epirubicin + Cisplatin + Capecitabin (ECX)
Epirubicin 50mg/m2 tiêm tĩnh mạch ngày 1
Cisplatin (CDDP) 60mg/m2 truyền tĩnh mạch ngày 1
Capecitabin (Xeloda) 625mg/m2, 2 lần/ngày, uống liên tục 21 ngày
Chu kỳ 21 ngày x 8 chu kỳ
Epirubicin + Oxaliplatin + 5-FU (EOF)
Epirubicin 50mg/m2 tiêm tĩnh mạch ngày 1
Oxaliplatin (Eloxatin) 130mg/m2 truyền tĩnh mạch ngày 1
5-FU 200mg/m2/ngày truyền tĩnh mạch liên tục 21 ngày
Chu kỳ 21 ngày, trong 8 chu kỳ
Epirubicin + Oxaliplatin + Capecitabin (EOX)
Epirubicin 50mg/m2 tiêm tĩnh mạch ngày 1
Oxaliplatin (Eloxatin) 130mg/m2 truyền tĩnh mạch ngày 1
Capecitabin (Xeloda) 625mg/m2, 2 lần/ngày, uống liên tục 21 ngày
Chu kỳ 21 ngày, trong 8 chu kỳ
Phác đồ 5-FU + Cisplatin
5-FU 1000mg/m2/ngày truyền tĩnh mạch từ ngày 1-5
Cisplatin (CDDP) 100mg/m2 truyền tĩnh mạch ngày 1
chu kỳ 21-28 ngày.
Cisplatin + Paclitaxel
Cisplatin (CDDP) 75mg/m2 truyền tĩnh mạch ngày 2
Paclitaxel (Taxol) 175mg/m2 truyền tĩnh mạch chậm ngày 1
chu kỳ 21 ngày
Docetaxel + Cisplatin + 5 FU
Cisplatin (CDDP) 75mg/m2 truyền tĩnh mạch ngày 1
Docetaxel (Taxol) 75mg/m2 truyền tĩnh mạch chậm ngày 1
5 FU 750mg/m2 truyền tĩnh mạch ngày 1-5
chu kỳ 21 ngày
Oxaliplatin + Capecitabin
Oxaliplatin (Eloxatin) 130mg/m2 truyền tĩnh mạch ngày 1
Capecitabin (Xeloda) 850-1000mg/m2, 2 lần/ngày, uống liên tục 14 ngày
chu kỳ 21 ngày
Cisplatin + Irinotecan
Cisplatin (CDDP) 80mg/m2 truyền tĩnh mạch ngày 1
Irinotecan (Camptosar, CPT-11) 80mg/m2 truyền tĩnh mạch ngày 1,8
chu kỳ 21 ngày.
Irinotecan + Oxaliplatin
Irinotecan (Camptosar, CPT-11) 150mg/m2 truyền tĩnh mạch ngày 1
Oxaliplatin (Eloxatin) 85mg/m2 truyền tĩnh mạch ngày 1
- Leucovorin100mg/m2 ngày 1
5-fluorouracil2000mg/m2 truyền tĩnh mạch liên tục 48 giờ
Chu kỳ 2 tuần
Trên đây là tổng quan về căn bệnh ung thư dạ dày, để được hỗ trợ điều trị kịp thời, bạn nên đến ngay các sơ sở của bệnh viện K để biết rõ tình trạng cơ thể mình
Nguồn: https://www.cancer.org/cancer/stomach-cancer.html
CHỦ ĐỀ ĐANG XEM:
- ung thư dạ dày

Xem thêm: Tác hại của thuốc lá đối với sức khỏe
Tin mới nhất
-
 Bà bầu có được ăn rau cần tây không? Có ảnh hưởng đến thai nhi?
Bà bầu có được ăn rau cần tây không? Có ảnh hưởng đến thai nhi?
- Top 3 Đặc Điểm So Sánh Nấm Linh Chi Vàng Hay Đỏ Tốt Hơn
- Khám phá bí mật ung thư tuyến tụy sống được bao lâu?
- Viêm da cơ địa có chữa khỏi được không? Nhận định từ chuyên gia
- Trung Tâm Đông Phương Y Pháp Dưới Góc Nhìn Chuyên Gia Hàng Đầu
- Vi Khuẩn Hp Là Gì Có Lây Không Triệu Chứng Điều Trị 2019
- Bệnh COVID-19 ở nam giới nặng hơn ở nữ: Đúng hay sai?
- Những điều bệnh nhân ung thư tuyến giáp giai đoạn 3 cần biết
- Đau bụng sau khi ăn: Nguyên nhân và cách chữa trị dứt điểm
- Trứng cá – món ăn cao cấp giàu dinh dưỡng cho mọi độ tuổi